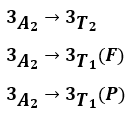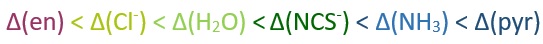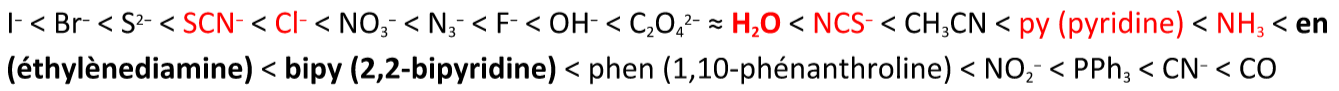Série spectrochimique du Nickel
Les complexes du Nickel
Objectifs de la manipulation
Cette manipulation a pour objectif de mettre en évidence les complexes stables du Nickel (II) à partir de différents ligands : chlorure (Cl-), éthylènediaminetétraacétate (EDTA), thiocyanate (SCN-), pyridine (C5H5N), ammoniac (NH3), eau (H2O), et éthylène diamine (en). L'objectif est ensuite de caractériser la série spectrochimique de ces ligands à partir de leur spectre d'absorption UV-visible.
Article rédigé par Bodin Jean-Baptiste et Lemonnier Tibault, élèves à l'ENS Paris-Saclay au département de chimie.
Introduction
Le Nickel : Ni, de numéro atomique 23, a pour configuration électronique [Ar]4s23d8, il possède donc 10 électrons de valence. Lors de nos expériences le Nickel est sous forme Ni(II). Ainsi si l'on suppose que ce dernier ne s'oxyde pas durant les manipulations, le Nickel (II) possède 8 électrons de valences.
Obtention de complexes stables et colorés
Dans un premier temps nous avons déterminé les complexes colorés stables que l'on pouvait obtenir. Pour cela nous avions à notre disposition les produits suivants.
Produits :
- Eau distillée
- Nitrate de Nickel(II) hexahydraté solide : Ni(NO3)2,(H2O)6 (s)
- Hydroxyde de sodium à 2 M : NaOH
- Ammoniac à 6M : NH3
- Pyridine : C5H5N
- EDTA : C10H16N2O8
- Thiocyanate de sodium solide NaSCN (s)
- Acide chlorhydrique à 12 M : HCl
- Ethylène diamine (en) : C2H4(NH2)2
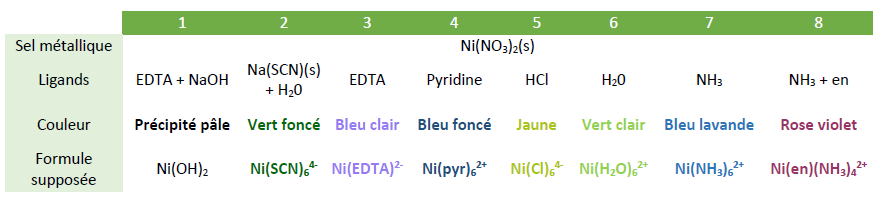
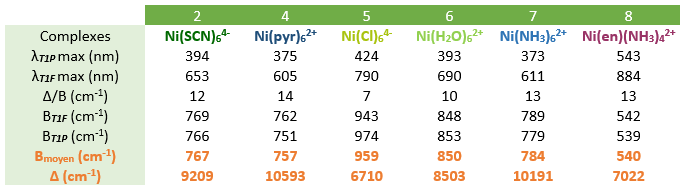
Dans des tubes à essai on a observé la formation de 8 complexes colorés, les résultats sont répertoriés dans le tableau ci-dessous :
Pour l'EDTA on a effectué l'expérience en milieu très basique avec NaOH et une autre fois sans NaOH. En effet l'EDTA est un tétraacide par ces quatre fonctions carboxylates, pour favoriser la complexation il semble donc logique de se placer en milieu basique. Cependant le tube à essai avec la soude mène à la formation d'un précipité blanc pâle que l'on suppose être Ni(OH)2 (s). L'expérience sans ajout de soude mène à la formation d'un complexe bleu clair qui pourrait être Ni(EDTA)2-.
Pour l'obtention du complexe rose violet du tube 8, on a ajouté de l'éthylène diamine dans un tube à essai contenant déjà le complexe bleu lavande Ni(NH3)62+. Cependant on ne sait pas si tous les ligands ammoniacs ont été remplacés.
Etudes des propriétés optiques des complexes
Quel type de transitions ?
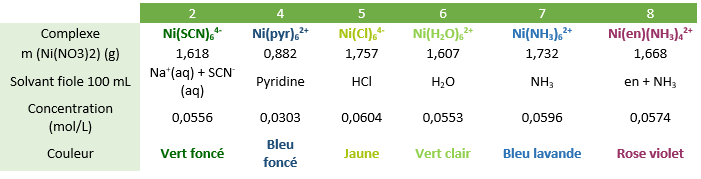
On réalise maintenant des solutions dont on connaît parfaitement la concentration en complexe formé. Pour cela on introduit une masse bien précise de nitrate de Nickel(II) hexahydraté dans des fioles de 100 mL, puis on remplit ces fioles avec les produits correspondants aux ligands désirés. Ainsi on se situe donc en large excès de ligands et la quantité de matière de complexe formé correspond donc à la quantité d'ions Nickel introduite. On a donc réalisé six fioles correspondant aux complexes : Ni(H2O)62+ , Ni(Cl)64-, Ni(NH3)62+, Ni(en)(NH3)42+, Ni(pyr)62+, Ni(SCN)64- . Les résultats sont indiqués dans le tableau ci-dessous.
Les spectre UV-visible de nos solutions sont ensuite obtenus entre 200 et 900 nm et sont disponibles par le lien ci-dessous.
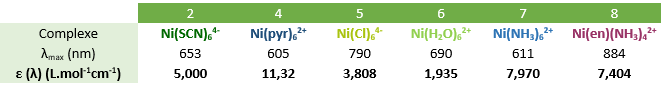
Pour chacun de ces spectres on s'intéresse aux bandes d'absorption dans le visible (400-800 nm) responsables de la coloration de la solution. A l'aide de la loi de Beer-Lambert, on peut donc déterminer pour chacune de ces transitions le coefficient d'absorption molaire correspondant à l'absorbance maximale. En effet A(λ) = ε (λ)*l*c avec A l'absorbance (sans unité), l la longueur de la cuve (en cm), c la concentration de notre complexe (en mol/L) et ε (λ) le coefficient d'absorption molaire spécifique à la longueur d'onde choisie (e mol/L/cm). Les résultats sont indiqués dans le tableau ci-dessous.
Les coefficients d'extinctions molaires ont donc un ordre de grandeur qui est d'environ 1 à 10 L/mol/cm, ces valeurs correspondent à des transitions d-d dans le complexe. Ces transitions dépendent fortement du champ de ligand et de la géométrie autour du cation métallique et elles sont partiellement interdites (par la règle de Laporte et par Δl = ± 1).
L'analyse de ces transitions d-d va nous permettre de déterminer la série spectrochimique des ligands.
Série spectrochimique des ligands
On peut maintenant déterminer l'énergie d'éclatement du champ de ligand : Δ, à l'aide des diagrammes de Tanabe-Sugano. Ces diagrammes représentent l'évolution de E/B : l'énergie des différents niveau électroniques normalisée par le paramètre de Racah B, en fonction de Δ/B. Le terme B représente les répulsions individuelles entre électrons d. Dans le diagramme de Tanabe-Sugano le niveau électronique fondamental est pris comme référence et à une énergie nulle quel que soit le champ de ligand. L'évolution des énergies des états excité est alors donné en fonction de Δ/B.
Pour nos complexes on est en présence d'un cation métallique d8 en symétrie octaédrique, le diagramme de Tanabe-Sugano correspondant est visible via le lien ci-dessous.
Diagramme de Tanabe-Sugano d8 Oh
Ce diagramme nous indique que trois transitions sont possibles par absorption (transitions tel que ΔS =0) :
Cependant sur l'ensemble des spectres obtenus seulement deux bandes d'absorptions sont visibles. On supposera que la transition la plus basse en énergie (vers 3T2), n'est pas visible sur nos spectres car trop haute en longueur d'onde.
Pour chacun de nos spectres, on détermine alors le quotient entre les longueurs d'ondes des deux maximas d'absorptions. Les résultats sont répertoriés dans le tableau ci-dessous. On lit alors sur le diagramme de Tanabe-Sugano l'abscisse pour laquelle on a le même rapport en énergie entre 3T1(F) et 3T1(P). C'est à cette abscisse qu'ont alors lieu les transitions électroniques pour chaque complexe étudié. Connaissant Δ/B il nous faut donc déterminer B pour avoir accès à Δ.
A l'abscisse déterminé précédemment, on obtient par lecture graphique les ordonnés E/B correspondant aux transitions vers 3T1(F) et 3T1(P). Sachant que l'on connaît les énergies de nos transitions électroniques grâce aux longueurs d'ondes qui leur sont associées, on peut déterminer B1 et B2. On détermine alors B par moyenne de ces deux valeurs, puis on en déduit Δ pour le complexe étudié.
Dès lors nous avons notre série spectrochimique :
On peut alors la comparer à la série spectrochimique théorique (en rouge les ligands étudiés) :
Conclusions
Le problème du ligand (en)
Si l'on compare la série spectrochimique que l'on obtient et celles accessible dans la littérature, une différence majeure apparaît : la valeur de notre champ de ligand pour l'éthylènediamine. En effet dans la littérature le champ de ce ligand est très proche de celui de l'ammoniac, cela paraît d'ailleurs logique puisque ces deux ligands sont très proches chimiquement : la liaison avec le métal se fait par le doublet non liant de l'azote. Le fait est que la couleur violette de notre complexe nous incite à penser que l'on a bien ajouté des ligands éthylènediamine, en effet notre complexe octaédrique constitué des ligands NH3 passe du bleu au violet lors de l'ajout d'éthylènediamine. De plus la littérature nous indique que cette couleur violette est bien caractéristique du complexe Ni(en)(NH3)42+ [1].
Cela peut venir du fait que notre complexe ne possède pas qu'un seul type de ligand, il est donc difficile de comparer le champ de ligand de l'éthylènediamine à celui des autres que l'on a déterminé pour des complexes avec six ligands identiques.
Mode de coordination du ligand thiocyanate
On a ajouté du thiocyanate de potassium à la solution contenant le complexe hexaaqua : Ni(H2O)62+, l'eau ayant un fort pouvoir dissociant on forme donc l'anion thiocyanate en solution. Cependant ce dernier peut être nucléophile par l'atome de soufre ou d'azote. En effet, par mésomérie deux formes limites sont possibles et donc deux types de complexations sont possibles : formation de liaisons métal-soufre ou métal-azote.

Avec les résultats que nous avons obtenus pour le champ de ligand du thiocyanate (Δ = 9209 cm-1), cela correspondrait d'après la série spectrochimique théorique à une complexation par l'atome d'azote. En effet une valeur plutôt proche du champ de ligand de l'eau (Δ = 8503 cm-1) va dans le sens d'une complexation par l'atome d'azote, tandis qu'une valeur plutôt proche du champ de ligand du chlorure (Δ = 6710 cm-1) va dans le sens d'une complexation par l'atome de soufre. On a donc des complexes Ni(NCS)64-.
Dans la littérature on apprend qu'expérimentalement les métaux dits de classe A (acides de Lewis durs) forment des complexes stables avec des bases de Lewis dures [2]. Le Nickel va plutôt être considéré d'après la théorie HSAB comme un acide dur : il est petit et peu polarisable et possède une charge assez importante (+2). Il va donc avoir tendance à se complexer plus facilement avec des ligands durs, or le ligands thiocyanate est plus dur en se complexant par l'azote que par le soufre. En effet le rayon ionique de l'azote (146 pm) est plus faible que le soufre (184 pm). [3]
Complexe Ni(NCS)64-
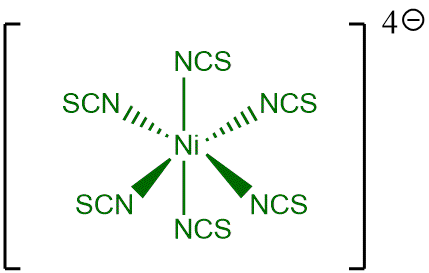
Calcul du pourcentage d'ionicité des liaisons métal-ligands
Pour l'ion libre Ni2+ on a le paramètre de Racach B0 = 1080 cm-1 [4]. En comparant cette valeur aux valeurs de B déterminées pour chaque ligand on peut alors en déduire le pourcentage d'ionicité de chacune des liaisons métal-ligand : β = B/B0. Les valeurs obtenues sont reportées dans le tableaux ci-dessous.
On classe donc nos ligands en fonction du pourcentage de la liaison métal ligand :
On remarque que dans ce classement les liaisons les moins ioniques sont celles avec des liaisons métal-azote. C'est logique l'atome d'azote est moins électronégatif que l'oxygène et le chlore, sa différence d'électronégativité avec le Nickel est donc plus faible et la liaisons est plus covalente.
Cependant l'oxygène est plus électronégatif que le chlore, or on obtient que la liaison métal-chlore est plus ionique que celle métal-oxygène (pour l'eau). En effet le ligand chlorure est un ligand de type X tandis que le ligand eau est un ligand de type L. Le ligand chlorure est alors plus susceptible de former une paire d'ions serrée (liaison totalement ionique) que le ligand H20.
On obtient des liaisons plus qu'à moitiés ioniques, c'est plutôt logique puisqu'on est en présence de liaisons entre un cation métallique très électropositif et des ligands du blocs p plutôt électronégatifs.
On remarque également que le pourcentage d'ionicité du ligand thiocyanate est plus proche de celles des ligands pyridine et ammoniac que de celle de l'eau. Cela va bien dans le sens d'une complexation par l'atome d'azote comme on l'a vu précédemment.
Analyse qualitative
On obtient que les ligands les plus donneurs : tel que Cl- (qui est sigma donneur et pi donneur) favorisent plus les champs faibles que les ligands les moins donneurs tel que la pyridine, NH3 et H20 qui sont juste sigma donneur.
On remarque que l'évolution de la couleur de nos complexes classés dans la série spectrochimique suit l'évolution inverse du spectre de la lumière à longueur d'onde croissante. C'est logique, aux basses énergies (delta faible) notre espèce absorbe de faibles longueurs d'ondes et donc apparaît de la couleur complémentaire : plutôt jaune. De même aux fortes longueurs d'ondes on absorbe du jaune et donc nos complexes apparaissent bleus. L'évolution colorée de nos complexes fonctionne bien (sauf pour (en)) et montre que le classement relatif de nos champs de ligands est à peut prêt juste.
Cependant si l'on compare à la série spectrochimique théorique, on observe une inversion entre les champs de ligands de la pyridine et de l'ammoniac. Ces deux ligands étant très proche chimiquement (ligand de type L se liant par l'azote) leurs valeurs sont donc très proches (Δ = 10593 cm-1 et Δ = 10191 cm-1). On peut donc supposer que l'inversion de ces deux champs de ligands peut venir des erreurs de lecture sur le diagramme.
Critique de la méthode
La lecture sur le diagramme de Tanabe-Sugnano que l'on a effectué est peu précise, cela peut être expliqué des petites différences entre les résultats expérimentaux et théoriques.
Par exemple la littérature nous indique le champ de ligand de NH3 en symétrie octaédrique est de 10800 cm-1 ce qui est tout de même assez proche de la valeur que l'on obtient qui est d'environ 10200 cm-1.
On obtient même des résultats très satisfaisant avec certains ligands, comme par exemple avec H20, pour lequel on est très proche de la littérature : Δ = 8500 cm-1 .
Finalement cette méthode nous permet d'avoir de bons ordres de grandeurs pour les valeurs de B et Δ, ainsi que l'évolution relative de ces derniers en fonction des ligands. Cependant certains écarts par rapports à la littérature peuvent se faire voir, pour y pallier on aurait pu tenter d'avoir accès aux équations des droites d'énergies du diagramme, et de déterminer alors en tout point Δ/B l'écart entre les niveaux d'énergie T1(F) et T1(P). Il y aurait alors moins d'incertitudes sur les valeurs que l'on avait déterminées graphiquement.
Bibliographie
- http://www.imbg-grenoble.fr/cours/2-Termes-spectro.pdf
- [1] http://culturesciences.chimie.ens.fr/content/les-complexes-de-nickel-ii-780
- [2] http://scienceworld.wolfram.com/chemistry/ClassAMetal.html
- [3] http://www.elementschimiques.fr/?fr/proprietes/chimiques/rayon-ionique
- [4] http://www.imbg-grenoble.fr/cours/2-Termes-spectro.pdf, pages 38-39